Orphan Drugs: ein mühsamer Weg
MADRID / EFE / ANA SOTERAS Dienstag 28/02/2017
Die Betroffenen von seltenen Krankheiten, die keine Heilung Look mit Hoffnung zu Orphan Drugs haben, einige Medikamente in einer sehr kleinen Bevölkerung richtet und deren Investitionen in Forschung und Entwicklung nicht kompensieren nicht die pharmazeutische Industrie, wenn nicht für die Anreize, die sie erhalten. Am Welt-Tag der Seltenen Krankheit, widmet sich der Forschung, gehen wir durch die beschwerliche Reise eines verwaisten
Droge.Weitere Nachrichten
- Patienten mit seltenen Krankheiten fordern einen staatlichen Fonds für ihre Behandlungen
- Was sind Biologics?

In Spanien, mehr als drei Millionen Menschen leiden an einige der mehr als 7.500 seltenen Krankheiten oder ultrarraras (jene, die weniger als 5 von 10.000 Menschen betroffen ist), aber nur 6% hat eine besondere Behandlung.
Die Orphans Drogen. Sie werden bei der Bekämpfung dieser Krankheiten abzielen. Von den 95 von der Europäischen Arzneimittel-Agentur (EMA) zugelassen seit 2002, 53 wurden bisher in Spanien verkauft, nach der spanischen Vereinigung aktualisiert Laboratory Orphans und Ultrahuérfanos Drugs (AELMHU) Daten.
Diese Partnerschaft spiegelt wider, dass es ein Abwärtstrend in der letzten Jahren: im Zeitraum 2002-2011, wenn das 42 Orphan Drugs in Europa zugelassen, 38 Spanien zugelassen wurden (90,5%) im Zeitraum 2012-2015 von 44 durch die EMA zugelassen, nur 13 erhielten das grüne Licht in Spanien (29.5%).
die Zeit seit der Annahme in Spanien Marketing von der EMA verstrichene betreffend durchschnittlich 20 Monate verbringen.
In diesem Sinne stellt der spanische Verband für seltene Krankheiten (FEDER), dass ein Medikament zu zwei Jahren dauern kann, Familien und die Tatsache zu erreichen, dass jede Region als ein eigenständiges System hat das alles nicht gleichermaßen Zugang hat so konfiguriert ist, diese Medikamente, so behaupten sie, nur Kriterien für den Zugang und den Prozess der Kommerzialisierung beschleunigen.
AELMHU, die auf der Entwicklung von innovativen zielgerichteten Therapien für Patienten mit seltenen und ultrarraras Krankheiten zusammen mehr als ein Dutzend Pharma- und Biotechnologie-Unternehmen, die sich bringt, sagt ein Bericht von 2015, dass „nur ein von zwischen 5.000 bis 10.000 Molekülen untersuchten schließlich auf den Markt kommt „und sie verbringen zwischen 10 und 12 Jahren seit der Synthese eines Arzneimittels zur Vermarktung.
Die durchschnittliche Investition für eine neue Behandlung beträgt 1.100 Millionen Euro.

Die Schritte der Waisen
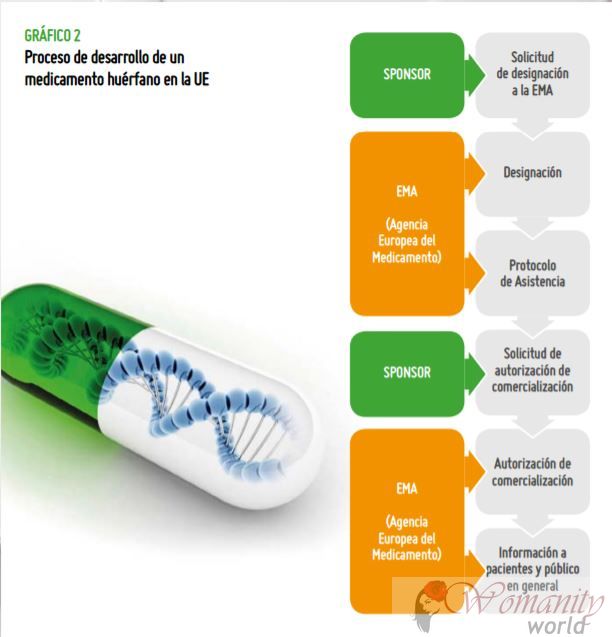
Drogen.Im Prozess der Entwicklung eines Orphan Drug gibt es zwei Hauptphasen:
1. Die Bezeichnung sowohl von der EMA in Europa durchgeführt wird, und die Food and Drug Administration (FDA) in den Vereinigten Staaten. Bezeichnung gibt an, dass es Hinweise darauf, dass dieses Medikament als präklinischen Tests wirksam sein kann. In der EMA, in diesem Fall, dann aktivieren sie Hilfe oder Anreize für die klinische Entwicklung (Tests an Patienten)
um fortzufahren.- Zehn Jahre Exklusivität in der EU nach der Zulassung.
- kostenlose wissenschaftliche Beratung: EMA Unterstützung auf verschiedenen Tests und Versuche durchgeführt werden, um die Qualität, Sicherheit und Wirksamkeit des Arzneimittels zu demonstrieren.
- Reduzierung oder Aufhebung der Gebühren in dem Verfahren.
- Die Förderung von Forschung: durch die Finanzierung oder EU-Mitgliedstaaten.
2. Die Genehmigung Wenn schließlich das Medikament zeigt Wirksamkeit, Qualität und Sicherheit und ist für die Vermarktung zugelassen.
„Das Problem ist, was sie die nennen. Death Valley Die Zeit seit dem Orphan-Drug-geben erhält, bis er Markt erreicht „, sagte Beatriz Gómez, Projektleiter am Zentrum für Biomedizinische Network Research für seltene Krankheiten (CIBERER).
Und in diesem Stadium ist in der Regel mit der Hürde zu bekommen Finanzierung, öffentlich oder privat gefunden, klinische Versuche zu unternehmen, die mehrere Jahre dauern können.
Mit der Zulassung ist keine Garantie, dass in verschiedenen Zuständen Patienten das Medikament zuzugreifen, da der Prozess der Finanzierung und Preisgestaltung in den einzelnen Ländern durchgeführt wird.
Ein Leitfaden für Forscher

CIBERER und die spanische Agentur für Arzneimittel und Gesundheitsprodukte (AEMPS) haben eine kurze Anleitung Forscher bei der Entwicklung von Orphan Drugs, um die Komplexität des Prozesses zu entmystifizieren.
CIBERER, die die verschiedenen Forschungsgruppen mit seltenen Krankheiten Projekte in ganz Spanien fördert und koordiniert, arbeitet auch für die Entwicklung neuer therapeutischer Strategien.
In diesem Sinne hat das Forschungszentrum Vernetzung gefördert und sechs als Orphan Drugs bezeichnet durch die EMA, drei von ihnen auch von der FDA ernannt.
Diese drei Arzneimittel Gentherapie (Technik, die das mutierte Gen durch ein anderes Recht auf seltene genetische Krankheiten ersetzt) und andere 3 Neupositionierung Medikamente bereits für eine andere Krankheit verwendet werden, die bei einigen seltenen Krankheiten nützlich sein können. Im letzteren Fall sind die Kosten weniger als