Experten argumentieren, dass die Zulassung von Arzneimitteln durch die Finanzierung von begleitet wird.
begleitet wird.
madrid / efe / nuria muñoz Freitag 2017.06.16
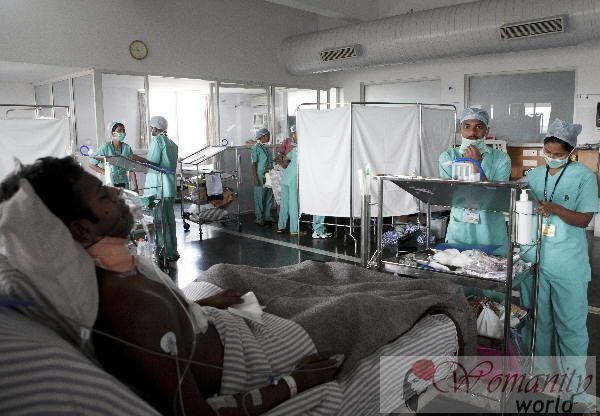
Frühe Zulassung eines Arzneimittels muß durch die Finanzierung begleitet werden, wie verschiedene Experten in der Pharmazie bei einem Seminar, das von der Stiftung für Gesundheitsforschung (FUINSA) in Madrid übereingestimmt haben, wo sie den Streit in dieser Angelegenheit untersucht
Weitere Nachrichten
- Ist gleich die Gesundheitsversorgung für Frauen als für Männer?
- Was sind Biologics?

An diesem Tag, die „Early Arzneimittelzulassung Beweise und Finanzierung“ berechtigt worden ist, haben sie adressiert auch die Beschränkungen für die Preisgestaltung von innovativen Arzneimitteln und Risiko für den Patienten den Zugang.
Die Debatte wurde durch den Präsidenten des FUINSA, Alfonso Moreno moderiert; CEO, Antón Herreros und Leiter der Klinischen Pharmakologie Clinical Hospital San Carlos de Madrid, Emilio, Emilio Vargas.
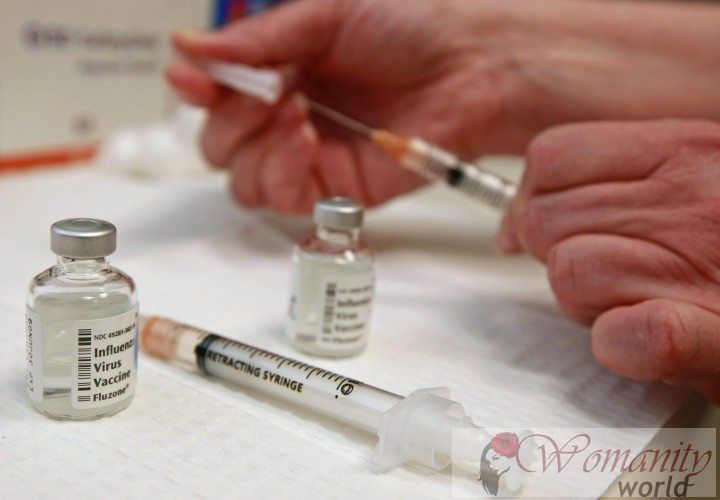
Bereichsleiter der Pharmazie und Medizin Konsortium für Soziale Gesundheit von Katalonien, Antoni Gilabert, betonte, dass „frühe Zulassung von Arzneimitteln müssen durch explizite Mechanismen zur Überwachung und Finanzierungsbedingungen begleitet werden, und ihre systematische Überprüfung auf den Ergebnissen basiert. "
Dieser Experte hat vorgeschlagen, Diskussionsforen genug erzeugen diese Frage zu beantworten: „Wie werden wir für diese neuen Medikamente bezahlen?“.
Farmaindustria technischer Direktor, Emili Esteve, hat argumentiert, dass „Hindernisse für die Finanzierung dieser Medikamente setzen weit von der Absicht des europäischen Gesetzgebers ist.“
„Um die Patienten Zugang zu diesen Arzneimitteln zu ermöglichen, während der Entscheidung über die Preisgestaltung und Kostenerstattung soll einen vorläufigen und revidierbar Preis zuweisen, sobald die endgültigen Finanzierungsbedingungen werden entschieden in Betracht gezogen werden“, ergänzte Esteve.
Vorzeitige Freigabe von Drogen „hat mit wenig Erkenntnisse über ihre Wirksamkeit und Sicherheit und unerschwinglich Kosten für Patienten und Gesundheitssysteme auf den Markt Drogen setzen“ klinische Pharmakologe Carcas Antonio La Paz Krankenhaus sichergestellt hat.

Diese Medikamente vorzeitige Entlassung trotz seiner Rekord in vielen bedingt durch die Europäische Arzneimittel-Agentur und der spanischen Agentur für Arzneimittel und Gesundheitsprodukte (AEMPS) mal, Zweifel an der vorgelegten Beweise und über die Angemessenheit ihrer Finanzierung durch die National Health System, wie bereits während der Debatte hervorgehoben.
Er betonte jedoch, der Vertreter des AEMPS Jorge Camarero: „Wir brauchen frühe Studien, gibt es Zeiten, in denen Drogen so viel versprechend, dass wir 15 Jahre nicht verlieren müssen gestärkt werden; wenn es so scheint, erhöht sich die Qualität und die Lebenserwartung, bevor der Patient“kommen muss.
Die Referenten einig, dass eine ausreichende Tests einmal das Medikament zugelassen sind, optimal für die externe Validität objektiv und haben eine post-Marketing intensive Überwachung zur Bestätigung der Wirksamkeit und Sicherheit wie pürierte Verwendung befürwortete diese Medikamente.
Der Leiter der Hämatologie und Hemoterapia San Carlos Clinical Hospital, Rafael Martínez, sagte, dass das wichtigste für ein Medikament zur Ausgabe genehmigt werden „ist es, die Erwartungen unserer Patienten zu verbessern.“